La pneumonie à pneumocystis a désormais acquis droit de cité chez le petit nourrisson et plus particulièrement chez le prématuré.
HISTORIQUE DE PNEUMONIE A PNEUMOCYSTIS DU NOURRISSON
Son histoire a d’abord été uniquement anatomopathologique et pendant une certaine période s’est confondue avec celle de la pneumonie interstitielle. En 1928, ROSSLE au Congrès des Pathologistes allemands de Wiesbaden attirait l’attention sur la pneumonie interstitielle non syphilitique du nourrisson et soulignait sa survenue chez les prématurés, l’absence de microbes et de cellules dans le contenu alvéolaire et l’infiltration lymphoplasmocytaire des cloisons inter- alvéolaires. A cette entité histopathologique, OTTO AMMICH de Berlin donnait en 1938 le nom de pneumonie interstitielle à plasmocytes et signalait comme permettant d’éliminer la syphilis l’absence de lésions artéritiques, l’absence de fibrine dans l’exsudat intra alvéolaire et l’absence de tréponèmes. De 1940 à 1953, de nombreux cas ainsi définis furent publiés surtout en Europe Centrale et en Suisse BENEKE de Rostock, FREUDENBERG et TOBLER de Berne, etc...).
Parallèlement et sans qu’au prime abord une relation avec l’histologie ait été entrevue, s’était poursuivie une étape parasitologique, caractérisée par l’identification du pneumocystis Carini. La découverte de celui-ci est due au Brésilien CHAGAS qui, en 1909, l’observant dans le poumon d’un homme mort de trypanosomiase l’appela “Trypanosoma rotatorium” et le considéra, à tort, comme une forme transitoire de trypanosome. CARINI le trouva chez le rat en 1910.
Mais c’est à M. et Mme D ELANO E (à qui CARINI avait envoyé ses lames) que revint le mérite de démontrer que le parasite n’a rien de commun avec le trypanosome ; ces auteurs le mirent en évidence chez de nombreux animaux : cobaye, rat, souris, lapin, chat, mouton, serpents et lui donnèrent son nom actuel de “Pneumocystis carinii “. Enfin, en 1942, Mlle Van Der MEER le retrouva dans les empreintes pulmonaires d’un enfant de trois mois et décrivit ses aspects avec précision.
Avec VANEK, JIROVEK et LUKES de Prague (1953) commença la dernière étape de l’histoire de la maladie : c’est eux qui eurent l’idée d’établir un rapprochement entre la pneumonie interstitielle et le pneumocystis, ce dernier étant toujours constatable dans l’exsudat intra alvéolaire si particulier de cette pneumonie. Cette liaison étroite a été confirmée par de nombreux auteurs.
Citons encore deux notions importantes plus récemment mises au point
- l’une est due à notre collaborateur, LE TAN VINH qui, en 1954, montra que l’exsudat intra alvéolaire à pneumocystis précède la lésion interstitielle et est constant ; par contre, la lésion interstitielle est secondaire, passagère, contingente : même du seul point de vue morphologique, il convient donc de dire “ pneumonie à pneumocystis “ et non “ pneumonie interstitielle
- l’autre est due à ZANDANELL qui, en 1959, signala qu’on pouvait trouver le pneumocystis dans tous les organes de l’enfant, et, par le procédé de la goutte épaisse, dans le sang.
Il reste maintenant à prouver le rôle étiologique du pneumocystis. Les uns admettent une théorie virale, d’autres une théorie mycosique, dans ces deux cas le pneumocystis n’étant qu’une association. Les autres admettent que le pneumocystis est l’agent pathogène de cette pneumonie à lésions si spéciales, mais se heurtent à l’impossibilité (jusqu’ici) de cultiver le parasite in vitro et de démonter expérimentalement son rôle pathogène. Notons cependant que le pneumocystis a pu être inoculé au jeune rat âgé de 3 jours et cortisoné : la discussion reste ouverte.
RÉPARTITION GÉOGRAPHIQUE
Malgré ce que pouvaient laisser croire les premières publications, la répartition géographique de la maladie est diffuse. Certes, l’affection a d’abord été observée en Europe Centrale, mais on en connaît maintenant 2.067 cas en Europe, répartis en Suisse, Finlande,
Allemagne, Tchécoslovaquie, Autriche, Yougoslavie, Italie, France (51 cas). L’aire géographique de l’affection s’étend à mesure que la maladie est mieux connue : Angleterre ( cas), Canada (24 cas), Etats-Unis (6 cas). Au Brésil, citons la publication de DONOSO et MEYERSTEIN (6 cas, en 1954), au Chili, les 10 cas de ARITZTIA (1957). Quelques cas ont été signalés en Afrique du Sud, en Australie, en Russie. La pneumonie à pneumocystis est d’autant moins rare qu’on cherche mieux à la dépister, chez les nourrissons de moins de 6 mois, chez les débiles, les prématurés, les nourrissons atteints de détresse respiratoire mal définie, dans les cas de morts inexpliquées.
ÉTUDE CLINIQUE DE PNEUMONIE A PNEUMOCYSTIS DU NOURRISSON
Au seuil de l’étude clinique, la notion essentielle à mettre en relief dès l’abord est celle du terrain. La pneumonie à pneumocystis frappe avant tout des nourrissons débilités pour des raisons diverses : prématurés, nouveau-nés de petit poids, jumeaux, nourrissons élevés dans les crèches, frappés de troubles digestifs et d’infections diverses, atteints de malformations congénitales et ne prospérant pas. A ce point de vue plusieurs observations de pneumonie à pneumocystis associées à une agammaglobulinémie sont particulièrement suggestives (RUSSELL).
L’âge aussi est une notion étiologique capitale : ce sont des nourrissons de 2 à 6 mois, toujours de plus de cinq semaines.
L’affection a été observée, en rafales épidémiques, dans les grandes collectivités de nourrissons, notamment en Suisse. Cependant, les 16 cas que nous avons pu étudier avec LE TAN VINH ont été sporadiques, observés un à un.
Le mode de contagion est inconnu ; la voie aérienne ou aérodigestive est la plus vraisemblable.
L’incubation est sans doute de 3 à 4 semaines ; elle peut être plus longue.
Dans sa forme commune, la maladie a un début insidieux et progressif ; les premiers symptômes sont minimes et s’étalent sur plusieurs semaines : arrêt de la croissance pondérale, puis chute de poids, quelques vomissements ou selles diarrhéiques ; poussées de fièvre en pointe. On cherche une otite, un foyer infectieux banal.
Peu à peu, les signes respiratoires deviennent prédominants. Au début, on les dépiste en comptant systématiquement le nombre de respirations : on note ainsi une polypnée croissante. A ce moment, les signes radiologiques sont déjà nets et contrastent avec la négativité des signes stéthacoustiques.
Ces prodromes peuvent s’étaler sur plusieurs semaines. A la période d’état, les signes sont nets. La dyspnée est évidente avec polypnée tirage et toux. Les signes stéthacoustiques restent discrets.
 |
| image 1 |
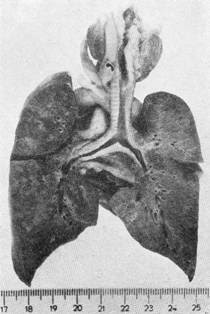
L’image radiologique (image 1) du thorax est très riche. Sur le cliché de face, opacités nuageuses, micro — ou macro nodulaires, hilifuges, bilatérales, avec hyperclarté des bases et des culs de sacs latéraux. Sur le cliché de profil, on trouve souvent une clarté emphysémateuse des zones périphériques, parfois un pneumothorax. Les ganglions médiastin aux ne paraissent pas hypertrophiés.
La température est normale ou peu modifiée l’hémogramme est peu altéré ; tout au plus une légère leucocytose avec polynucléose modérée ; pas d’augmentation des plasmocytes. La vitesse de sédimentation est peu modifiée ; le taux des agglutinines froides n’est pas augmenté. Pas d’albumine dans les urines.
L’évolution aboutit le plus souvent à la mort dans un syndrome de détresse respiratoire aigu qui emporte le petit malade en deux ou trois jours ou même subitement en quelques heures.
 |
| image 2 |
ANATOMIE PATHOLOGIQUE
Dans l’état actuel de nos connaissances, c’est l’examen anatomopathologique des pièces d’autopsie qui est caractéristique.
Au stade initial, il y a peu d’altérations macroscopiques notables la plèvre est normale, le poumon non congestionné, ni infiltré ; il est régulièrement aéré. Et cependant, à ce stade où les lésions ne
sont pas macroscopiquement visibles Le TAN VINH a pu déceler les lésions microscopiques typiques.
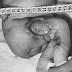
A la période d’état, seuls les poumons sont atteints, les autres organes sont indemnes. Les poumons apparaîssent non collabés, lourds, non aérés, sauf au niveau des languettes antérieures qui sont gonflées d’emphysème; on peut noter un pneumothorax. A la coupe, la sur face de section est le siège d’une infiltration blanchâtre alternant avec des zones violacées : c’est la pneumonie blanche ou marbrée (image 2). La pression ne fait sourdre ni pus, ni mousse, mais un peu de liquide épais et visqueux. Il n’y a pas d’abcès, pas de cavités. Les ganglions du hile ne sont que modérément hypertrophiés. Les lésions peuvent être limitées à un seul poumon, ou même à un seul lobe.
 |
| image 3 |
A un stade avancé ( image 3) l’aspect macroscopique est redevenu banal et non significatif: on ne retrouve qu’une banale congestion des gouttières postérieures et des bases, le reste du poumon est rose ou d’aspect emphysémateux et l’infiltration blanchâtre a disparu.
Par contre, à chacun de ces trois stades macroscopiques, l’aspect microscopique est caractéristique.
 |
| image 4 |
Le stade initial montre de petits foyers d’exsudat aréolaire en nid d’abeilles, (image 4) séparés les uns des autres par de larges zones de parenchyme pulmonaire sain. Fait capital, bien mis en évidence par LE TAN VINH, à ce moment les parois alvéolaires sont normales, l’exsudat intra alvéolaire a précédé l’infiltration interstitielle. L’exsudat est composé par une substance légèrement granuleuse, complètement acellulaire et amicrobienne au faible grossissement et à l’hématéine éosine. A un grossissement suffisamment fort, cet exsudat est constitué par un ensemble de petites logettes ; à l’intérieur de ces logettes, la coloration à l’argent fait apparaître des kystes et des formes libres de pneumocystis Carinii. Les formes libres se présentent comme des points arrondis ; les kystes ont I, 2 ou 8 éléments, chaque élément étant un petit point noir arrondi, entouré d’un halo protoplasmique un peu plus clair.
 |
| image 5 |
Au stade d’état, (image 5) la réaction septale vient s’ajouter à l’exsudation intra alvéolaire. Cette réaction apparaît par poussées successives et dans un même poumon se juxtaposent des lésions d’âges différents. L’infiltration qui épaissit les cloisons septales est faite de cellules mononucléées, lymphocytes, histiocytes, plasmocytes.
Au stade avancé (image 6), l’exsudat en nid d’abeilles disparaît une réaction cellulaire envahit les foyers les plus anciens ; elle est faite de macrophages à cytoplasme spumeux, contenant des granulations éosinophiles, de cellules à poussières, exceptionnellement de polynucléaires. A ce moment, le diagnostic est plus difficile ; il est encore basé essentiellement sur la mise en évidence des kystes de pneumocystis.
 |
| Image 6 |
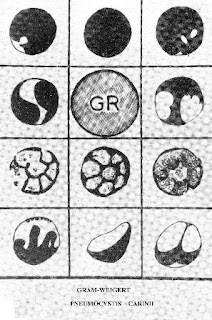
A tous les stades, la technique des empreintes pulmonaires colorées par le Gram Weigert facilite le diagnostic des kystes, les seuls caractéristiques étant à 8 noyaux. Le May Grunwald Giemsa les colore en moins grand nombre mais montre des aspects plus différenciés.
Telles sont les bases du diagnostic anatomo-clinique. Elles sont telles que les seuls cas de pneumonie à pneumocystis bien démontrés sont des vérifications d’autopsie.
DIAGNOSTIC
Les pneumopathies à pyogènes, particulièrement à staphylocoques, actuellement si fréquentes chez les petits nourrissons, sont faciles à différencier. Il en est de même de la tuberculose ganglio-pulmonaire qui ne pose guère de problème que dans sa forme miliaire. La pneumonie syphilitique n’a plus à être citée que pour mémoire. Les véritables discussions doivent se faire avec la forme respiratoire, broncho-pulmonaire, de la mucoviscidose ou fibrose kystique du pancréas, avec la pneumonie à inclusions cytomégaliques, avec la fibrose pulmonaire primitive du type HAMMAN-RICH.
Le diagnostic positif -intra-vitam- est maintenant possible. Evidemment pour faire pendant la vie du petit malade le diagnostic de pneumonie à pneumocystis il faut d’abord y penser. Le clinicien doit être alerté par l’insidiosité du début, la progressivité de l’installation du syndrome dyspnéique, l’évolution sur plusieurs semaines,
la survenue des symptômes sur un organisme débilité, la pauvreté des signes stéthacoustiques contrastant avec l’intensité des troubles fonctionnels d’une part, et d’autre part avec la richesse et l’étendue des images radiologiques.
 |
| Image 7 |
La difficulté est de mettre en évidence chez le malade le pneumocystis. Nous avons d’abord utilisé des prélèvements obtenus par ponction pulmonaire transthoracique. Nous préférons examiner l’expectoration de l’enfant recueillie par aspiration pharyngée.
CARINI et MACIEL avaient déjà essayé - sans succès - de colorer les kystes de pneumocystis dans les produits recueillis dans la trachée et les bronches d’animaux de laboratoire infectés. VANEK, JIROVEK et LUKES dans leur mémoire de 1953 écrivaient que le “ diagnostic microscopique pendant la vie des malades est impossible “.
Notre collaborateur LE TAN VINH, dans notre laboratoire, a eu le mérite de résoudre le problème en appliquant la coloration de Gram Weigert (et non le May Grunwald Giemsa) sur les produits d’expectoration aspirés à la sonde.
Le prélèvement de l’expectoration se fait de la manière suivante introduire par le nez une sonde molle (urétrale) montée sur une seringue de 20 cc. Limiter la longueur à engager selon l’âge de l’enfant : il suffit d’atteindre l’orifice supérieur du larynx sans le dépasser. Le contact de l’extrémité de la sonde avec l’orifice supérieur du larynx suffit à provoquer une secousse de toux expulsive : c’est à ce moment précis qu’il faut aspirer à deux ou trois reprises et juste avant de retirer la sonde. Il est inutile de chercher à cathétériser le larynx.
 |
| Image 8 |
Avec le matériel recueilli, on prépare des frottis sur lames que l’on fixe immédiatement, sans sécher, pendant 20 minutes, dans un mélange à parties égales d’éther et d’alcool éthylique à 90°. Retirer les lames après fixation et laisser sécher. Elles sont prêtes pour être colorées selon la technique du Gram-Weigert habituelle en histologie.
L’étude comparative des empreintes ou des frottis de poumon colorés, d’une part par le May Grunwald Giemsa et d’autre part par le Gram-Wiegert montre que la coloration par le Gram Weigert est beaucoup plus sensible : alors que le Giemsa ne colore aucun kyste ou seulement I ou 2, le Gram Weigert en colore des amas de 12 à 20.
Mais d’autre part alors que le May Grunwald Giemsa donne les images déjà bien connues dont les caractèrres sont les suivants (image 9): coque bien arrondie, non colorée, mais claire et refringente, nettement délimitée, à l’intérieur de laquelle on voit huit éléments intrakystiques eux-mêmes, arrondis ou ovalaires à noyau violet, à cytoplasme peu abondant, plus pâle, bleue - celles fournies par le Gram Weigert ont une apparence différente, au premier abord déroutante, qu’on apprend à identifier par l’expérience.
 |
| Image 9 |
Tout se passe comme si le Gram Weigert colorait non les éléments intra kystiques, mais électivement et seulement la coque du kyste et les cloisons des compartiments qui le segmentent, le May Grunwald Giemsa au contraire ne colorant que les éléments contenus à l’intérieur des compartiments (image 7, 8, 9, 10 et 11). Pour expliquer la grande variabilité des images obtenues avec le Gram-Weigert, il faut aussi tenir compte du stade évolutif du kyste et de l’incidence d’observation : de face, de profil, ou plus ou moins oblique. D’où des aspects arrondis, discoïdes, ou en cupule ou en rosace plus ou moins régulière. A chaque méthode correspondent donc des images lui appartenant en propre.
Grâce à la technique de LE TAN VINH, il n’est pas douteux que la recherche systématique des pneumocystis dans le produit d’expectoration du malade recueilli par aspiration pharyngée à la sonde permettra plus souvent que par le passé le diagnostic de la maladie.
 |
| Image 10 |
Nul doute alors que le tableau clinique classique ne s’enrichisse de formes nouvelles, formes non mortelles, curables, ou même légères et atténuées. Dans le service, nous avons déjà pu faire ainsi le diagnostic in vivo dans 4 cas ; dans deux de ces cas, le diagnostic a été confirmé par la vérification nécropsique.
TRAITEMENT DE PNEUMONIE A PNEUMOCYSTIS DU NOURRISSON
Dans l’état actuel de nos moyens, le traitement de cette affection n’est que symptômatique oxygénothérapie, réhydratation, correction des troubles métaboliques, toni-cardiaques. Nous avons l’habitude de prescrire une médication anti-fungique (mycostatine) et comme anti-parasitaire, des injections intramusculaires de Glucan-time (2168 RP) à la dose qutotidienne de 0,06 à -0 g 10/kg/24 h. ou
de Néo Stibosan (0 gr 05/kg/24 h.) dilué à 1000 dans l’eau distillée, ou des injections intraveineuses de Stilbamidine (4 mg/kg/24 h.) également très diluée. Les injections de gammaglobulines peuvent être tentées. Malgré ce traitement, l’évolution est le plus souvent mortelle. Cependant des 4 cas que nous avons pu diagnostiquer in vivo, 2 sont en vie, l’un guéri, l’autre actuellement encore dans le service, évoluant favorablement. Il est donc permis d’espérer que ce traitement a une certaine efficacité et est capable d’améliorer le pronostic.