La glande interstitielle du testicule adulte apparaît comme une glande endocrine. Ses élaborations hormonales, multiples, tiennent notamment sous leur dépendance la morphologie et le fonctionnement d’un certain nombre d’organes ou de tissus ; plusieurs de ces organes sensibles à l’action des hormones mâles apparaissent comme des «caractères sexuels secondaires ».
Le problème d’histophysiologie relatif à l’activité endocrine du testicule consiste à localiser la source cellulaire des hormones mâles.
A. Généralités
Les hormones mâles (comme d’ailleurs les hormones femelles) déterminent, à un certain moment de la vie, une transformation morphologique de l’individu qui le fait passer de l’habitus du sujet impubère à l’aspect du sujet adulte; cette différenciation sexuelle se traduit par l’acquisition de caractères sexuels secondaires.
On classe en effet, rappelons-le, les caractères sexuels de la façon suivante:
1. Caractères sexuels primordiaux correspondant au sexe génétique fixé à la fécondation et résultant de la combinaison chromosomique des cellules sexuelles des procréateurs (combinaison d’autosomes et d’hétérochromosomes)
2. Caractères sexuels primitifs, correspondant au sexe gonadique, apparaissant chez l’embryon et résultant de l’évolution d’une gonade d’abord indifférenciée;
3. Caractères sexuels primaires, correspondant au sexe gonophorique, apparaissant après le développement de la gonade et sous l’influence des sécrétions de cette gonade dans ces conditions se constituent les conduits génitaux et leurs glandes annexes, ainsi que les organes génitaux externes ;
4. Caractères sexuels secondaires, correspondant au sexe somatique qui se manifeste après la puberté et qui se traduit par le développement harmonieux de certains organes-cibles; ce développement prouve l’action morphogène des hormones sexuelles ; ces caractères ne se manifestent pas en l’absence des hormones sexuelles 1.
B. Origine cellulaire des hormones mâles
Le testicule adulte comprend en somme trois éléments:
- les cellules germinales;
- les cellules de Sertoli,
- les cellules de Leydig.
Pour établir l’origine cellulaire des hormones mâles, on recherche, par des combinaisons expérimentales ou par l’observation de cas pathologiques, un parallèle entre l’état du développement de ces constituants du testicule et la présence (ou l’absence) des caractères sexuels secondaires.
1. CARACTÈRES SEXUELS SECONDAIRES ET GLANDE INTERSTITIELLE
Nous résumons, dans le tableau synoptique ci-après, l’influence de certaines circonstances expérimentales ou pathologiques sur les trois catégories d’éléments testiculaires.
En somme, les caractères sexuels secondaires ont un développement parallèle à celui de la glande interstitielle.
________________________________________________________________________
circonstances lignée cellules cellules caractères
d’observation germinale de Sertoli de Leydig sexuels
secondaires
________________________________________________________________________
ligature du canal absente normales normales développés déférent
dissociation diastémato-
spermatique
cryptorchidie
________________________________________________________________________
injection de gonado- absente peu développées activées développés stimuline (ICSH) à
l’animal impubère
________________________________________________________________________
injection de gonado- activée développées absentes absents stimuline (FSH) à
l’animal impubère
________________________________________________________________________
carence vitaminique conservée conservées détruites absents A ou B
________________________________________________________________________
irradiation (400 r) différenciée différenciées détruites arrêt du
chez l’animal pré pubère développement
________________________________________________________________________
irradiation (10000 r) détruite détruites persistantes persistants chez l’adulte
________________________________________________________________________
tumeurs à cellules absente peu développées hyperplasiées pseudo-puberté
interstitielles précoce
chez l’enfant
________________________________________________________________________
2. CAS PARTICULIER DE LA «DISSOCIATION DIASTEMATO-SPERMATIQUE»
L’absence naturelle, expérimentale, ou pathologique, de la lignée germinale avec persistance de la glande interstitielle (ou glande diastématique) réalise une «dissociation diastémato-spermatique ».
Une telle dissociation existe à l’état naturel chez les Mammifères hibernants, à diverses périodes de l’année.
Des observations, comprenant simultanément une étude cytologique de l’antéhypophyse et de tout l’appareil génital, ont été effectuées, par exemple, chez le Hérisson [travaux de GIR0D et CURÉ (1965)]
- de mai à août, la glande diastématique et ses organes-cibles sont fort développés ; il en est de même des tubes séminifères
- en octobre, les cellules interstitielles et leurs organes-cibles ont subi une profonde involution, alors que de nombreuses images de spermatogénèse s’observent encore dans les tubes séminifères
- en mars et avril, la glande interstitielle et ses organes-cibles ont récupéré une activité importante, tandis que la spermatogénèse n’est pas encore rétablie.
Cette dissociation peut être réalisée expérimentalement chez l’animal en détruisant soit seulement la lignée germinale soit seulement la glande diastématique. (cf. tableau ci-dessus).
Des expériences effectuées chez le Singe ont permis d’étudier diverses modalités de cette dissociation [recherches de GIR0D (1964-1966)] chez le Singe, le chlorure de cadmium entraîne une nécrose des trois catégories d’éléments cellulaires du testicule ; si l’on suit la réparation spontanée de ces lésions, on observe que plusieurs mois après l’injection de Cl2Cd, elle s’effectue dans un ordre défini:
- les cellules de Sertoli se reconstituent d’abord;
- puis les cellules interstitielles réapparaissent;
- enfin la lignée germinale se reforme lentement.
Or les organes-cibles des hormones mâles ne récupèrent leur morphologie «normale» qu’au moment de la reconstitution de la glande interstitielle (ils ne sont pas développés quand les cellules de Sertoli peuplent les tubes séminifères).
La pathologie humaine ou animale réalise un tableau de dissociation diastémato-spermatique: c’est le cas du testicule cryptorchide (testicule en position ectopique, inguinale ou abdominale) ou du syndrome de DEL CASTILLO ou encore du syndrome de KLINEFELTER (Image 1) ; de telles dissociations peuvent s’observer chez des hommes stériles sans modification du caryotype (Image 2).
Dans le testicule cryptorchide le diamètre des tubes séminifères est toujours inférieur aux valeurs «normales» ; la lignée germinale est soit absente soit très réduite (comprenant, lorsqu’elle existe, des altérations qualitatives) - Les cellules de Sertoli sont cependant abondantes. Quant à la glande interstitielle, elle est développée (paraissant même plus importante; mais ce n’est qu’une impression due aux proportions respectives du volume des tubes et du volume des espaces intertubulaires) - Les caractères sexuels secondaires se sont développés normalement.
3. LES TUMEURS TESTICULAIRES ENDOCRINES
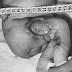
Il existe, chez l’Homme comme chez l’animal, des tumeurs sécrétantes des cellules de Leydig (Image 3) ; elles entraînent des modifications générales liées à l’hypersécrétion d’androgènes.
 |
| Image 1. Aspects pathologiques du testicule humain |
1 et 2 Testicule cryptorchide. Noter que dans le tube séminifère, dont la membrane propre est normale, il ne persiste que des cellules de Sertoli Remarquer le développement apparent de o glande interstitielle.
3. Syndrome de Del Castillo, Trabucio et De la Balze ( «Sertoli cell only syndrome » des auteurs anglo-saxons) le tube séminifère est occupé uniquement par des tel ules de Sertoli noter le léger épaississement e la membrane propre du tube es ce lues de Leydig ne sont pas modifiées.
4. Syndrome de Khinefelter avec caryotype 47, XXY. Remarquer épaississement de la membrane propre du tube, les lésions de la paroi tubulaire dans laquelle on ne reconnaît que des cellules de Sertoli les cellules de Leydig hypertrophiées.
a. OBSERVATIONS IN VIVO
L’existence de tumeurs sécrétantes à cellules de Leydig développées chez le jeune enfant est très instructive
- une telle tumeur entraîne un développement précoce des caractères sexuels secondaires;
- si elle n’intéresse qu’un seul testicule, l’ablation chirurgicale de cette néoplasie provoque, chez cet enfant n’ayant pas atteint l’âge de la puberté, une régression des caractères sexuels secondaires prématurément développés;
- mais ces caractères sexuels réapparaissent lorsque le testicule intact subit la maturation morphologique et fonctionnelle caractéristique de la puberté.
 |
| Image 2. Aspects pathologiques du testicule humain observés chez hommes stériles sans modification du caryotype |
1. Aspects de plusieurs tubes séminifères ; l’épaississement des membranes propres varie d’un tube à l’autre.
2 et 3 Aspects, à de plus forts grossissement des tubes séminifères ; noter la disparition presque complète des éléments de la lignée germinale et l’épaississement important des membranes propres.
b. OBSERVATIONS IN VITRO
Des tumeurs humaines à cellules de Leydig ont pu être cultivées in vitro; dans ces conditions, on a pu suivre toutes les étapes de la biosynthèse des androgènes par ces cellules2.
Chez l’animal, on rencontre également des tumeurs des cellules de Leydig: chez le Rat, de telles tumeurs peuvent être greffées ; si elles sont greffées à des animaux ayant subi une castration pré- pubertaire, la sécrétion du greffon entraîne un développement, d’ailleurs considérable, des caractères sexuels secondaires [expériences de COURRIER et coll. (1964-1965)].
Les cellules interstitielles du Rat peuvent également être mises en culture ; dans ces conditions, on y a détecté de la 3 β - hydroxystéroïde déshydrogénase [STEINRERGER et coll. 1966-1967)].
 |
| Image 3. Tumeurs à cellules de Leydig |
1. Aspect au faible grossissement.
2 Aspect au fort grossissement.
________________________________________________________________
1 - Certains auteurs ont parlé de caractères sexuels tertiaires pour désigner le sexe psychologique.
2 - Puar être plus près de la vérité, il faut bien reconnaîtra que certaines tumeurs sécrétantes du testicule humain possèdent des systèmes enzymatiques « anormaux » par rapport aux cellules de Leydig « habituelles » en effet, de telles tumeurs peuvent élaborer toute une variété de C19 et C21- stéroïdes [ENGEL et coll. (1966)].